晶体具有规则的几何外形,晶体中最基本的重复单位称晶胞。氯化钠晶体结构如图所示,已知NixO晶体晶胞结构为氯化钠型,由于晶体缺陷,x值小于1,测知NixO晶体的密度为7.4g/cm3,晶胞边长为4.0×10-10m(NA用6.0x1023计算)。试回答(要求计算过程):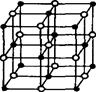
(1)NixO晶体中的x值_________(精确到0.01)。
(2)晶体中的Ni分别为Ni2+、Ni3+,此晶体化学式____________(用含Ni2+、Ni3+表示)。
晶体具有规则的几何外形,晶体中最基本的重复单位称晶胞。氯化钠晶体结构如图所示,已知NixO晶体晶胞结构为氯化钠型,由于晶体缺陷,x值小于1,测知NixO晶体的密度为7.4g/cm3,晶胞边长为4.0×10-10m(NA用6.0x1023计算)。试回答(要求计算过程):
(1)NixO晶体中的x值_________(精确到0.01)。
(2)晶体中的Ni分别为Ni2+、Ni3+,此晶体化学式____________(用含Ni2+、Ni3+表示)。