甲、乙、丙、丁是原子序数依次增大的短周期元素,甲与丙、乙与丁分别同主族,甲、丙均可与乙形成原子个数之比为1:1和2:1的化合物。由甲、乙、丁中的一种或几种元素可组成下列转化关系中的所有物质。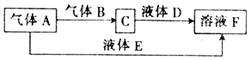
请回答下列问题:
(1)丙元素的离子结构示意图为
(2)E的电子式为
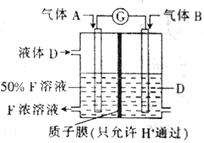
(3)科学家提出设想,以右上图所示装置利用电化学原理生产溶液F,写出通入气体A的一极的电极反应式:
甲、乙、丙、丁是原子序数依次增大的短周期元素,甲与丙、乙与丁分别同主族,甲、丙均可与乙形成原子个数之比为1:1和2:1的化合物。由甲、乙、丁中的一种或几种元素可组成下列转化关系中的所有物质。

请回答下列问题:
(1)丙元素的离子结构示意图为
(2)E的电子式为
(3)科学家提出设想,以右上图所示装置利用电化学原理生产溶液F,写出通入气体A的一极的电极反应式: