通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的焓变(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 |
H---H |
Cl---Cl |
H---Cl |
| 生成1 mol化学键时所放出的能量(kJ·mol-1) |
436 |
243 |
431 |
则下列热化学方程式不正确的是( )
A.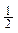 H2(g)+ H2(g)+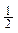 Cl2(g)=HCl (g) ΔH= ﹣91.5 kJ·mol-1 Cl2(g)=HCl (g) ΔH= ﹣91.5 kJ·mol-1 |
| B.H2(g)+ Cl2(g)=2HCl (g) ΔH= ﹣183kJ·mol-1 |
C.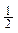 H2(g)+ H2(g)+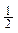 Cl2(g)=HCl (g) ΔH= ﹢91.5 kJ·mol-1 Cl2(g)=HCl (g) ΔH= ﹢91.5 kJ·mol-1 |
| D.2HCl(g)=H2(g)+ Cl2(g) ΔH= ﹢183kJ·mol-1 |
 ,加热后加入AgNO3溶液
,加热后加入AgNO3溶液

 粤公网安备 44130202000953号
粤公网安备 44130202000953号