下图所示为实验制取纯净干燥的Cl2,并进行检验Cl2性质的实验装置。其中E瓶中放有干燥红色布条,F中为铜网,F右端出气管口附有脱脂棉。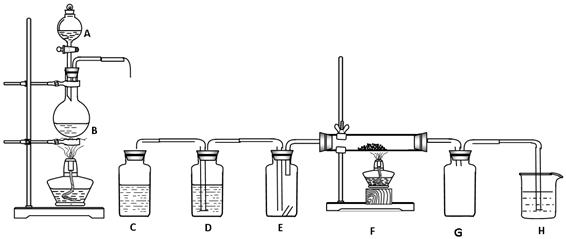
(1)洗气瓶C、D中分别盛有的试剂是 、 。
(2)E中现象是 ,
(3)F中反应的化学方程式为 。
(4)B中反应的离子方程式为 。
(5)整套装置中有两处酒精灯加热,实验时应先点燃 处的酒精灯。
下图所示为实验制取纯净干燥的Cl2,并进行检验Cl2性质的实验装置。其中E瓶中放有干燥红色布条,F中为铜网,F右端出气管口附有脱脂棉。
(1)洗气瓶C、D中分别盛有的试剂是 、 。
(2)E中现象是 ,
(3)F中反应的化学方程式为 。
(4)B中反应的离子方程式为 。
(5)整套装置中有两处酒精灯加热,实验时应先点燃 处的酒精灯。