(7分) 根据下列变化关系,回答相关问题: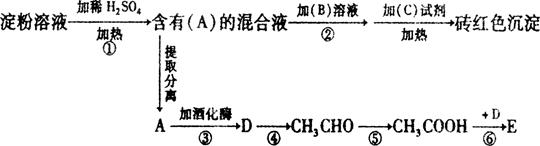
(1)A物质的名称____________;B溶液为______________;C试剂为________________;
(2)写出④、⑥两步反应的化学方程式
④ ____________________________________________________
⑥_____________________________________________________
(7分) 根据下列变化关系,回答相关问题:
(1)A物质的名称____________;B溶液为______________;C试剂为________________;
(2)写出④、⑥两步反应的化学方程式
④ ____________________________________________________
⑥_____________________________________________________