已知乙烯能发生以下转化:
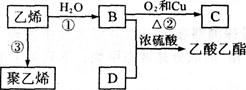
(1)乙烯的结构式为:_________________________。
(2)写出下列化合物官能团的名称:
B中含官能团名称___________;D中含官能团名称____________。
(3)写出反应的化学方程式及反应类型:
①______________________________________________;反应类型:________。
②_____________________________________________。
已知乙烯能发生以下转化:

(1)乙烯的结构式为:_________________________。
(2)写出下列化合物官能团的名称:
B中含官能团名称___________;D中含官能团名称____________。
(3)写出反应的化学方程式及反应类型:
①______________________________________________;反应类型:________。
②_____________________________________________。