可逆反应: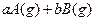

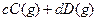 ,取
,取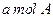 和
和 置于V L容器内。1分钟后,测得容器内A的浓度为
置于V L容器内。1分钟后,测得容器内A的浓度为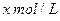 ,这时B的浓度为__ _ _ _ _ _ ______
,这时B的浓度为__ _ _ _ _ _ ______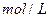 ,C的浓度为___ _ _ _ ____
,C的浓度为___ _ _ _ ____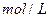 。这段时间内反应的平均速率若以物质A的浓度变化来表示,应为______ ____ _。
。这段时间内反应的平均速率若以物质A的浓度变化来表示,应为______ ____ _。
可逆反应: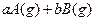

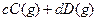 ,取
,取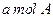 和
和 置于V L容器内。1分钟后,测得容器内A的浓度为
置于V L容器内。1分钟后,测得容器内A的浓度为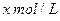 ,这时B的浓度为__ _ _ _ _ _ ______
,这时B的浓度为__ _ _ _ _ _ ______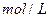 ,C的浓度为___ _ _ _ ____
,C的浓度为___ _ _ _ ____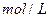 。这段时间内反应的平均速率若以物质A的浓度变化来表示,应为______ ____ _。
。这段时间内反应的平均速率若以物质A的浓度变化来表示,应为______ ____ _。