反应2C + O2=2CO 的能量变化如右图所示。含11.2g KOH的稀溶液与1L0.1mol/L的H2SO4溶液反应放出11.46kJ的热量,下列说法正确的是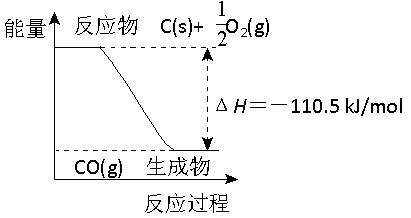
| A.2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ 1 |
| B.12 g C(s)与一定量O2(g)反应生成14 g CO(g),放出的热量为110.5 kJ |
| C.该反应的热化学方程式是:2C(s) + O2(g)=2CO(g) ΔH=-110.5 kJ/mol |
| D.表示中和热的热化学方程式2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l)ΔH=-114.6 kJ/mol |
 粤公网安备 44130202000953号
粤公网安备 44130202000953号