已知甲、乙、丙是三种常见的单质,且组成它们的元素核电荷数之和为35;A-G是七种常见化合物:上述各物质间的相互转化关系如下图所示(反应条件和其它生成物略)。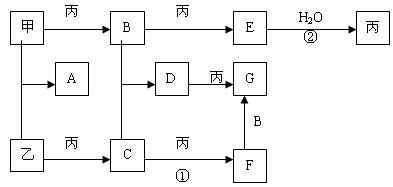
试回答:
(1)B的化学式是:______,D的名称是_________;
(2) 写出①、②两步变化的化学方程式:
已知甲、乙、丙是三种常见的单质,且组成它们的元素核电荷数之和为35;A-G是七种常见化合物:上述各物质间的相互转化关系如下图所示(反应条件和其它生成物略)。
试回答:
(1)B的化学式是:______,D的名称是_________;
(2) 写出①、②两步变化的化学方程式: