某有机物A,由C、H、O三种元素组成,在一定条件下,A、B、C、D、E、F具有下列转化关系:
已知D的蒸气密度是氢气的29倍,并可以发生银镜反应。
(1)写出F的结构简式 ▲ ;
(2)写出C → A的反应条件 ▲ ;
(3)写出A → D的反应方程式 ▲ 。
写出B → C的反应方程式 ▲ 。
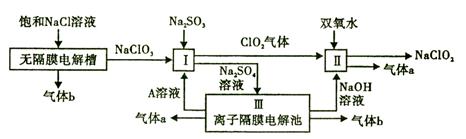
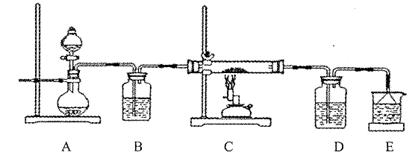
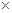 10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中
10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中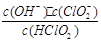 = 。
= 。
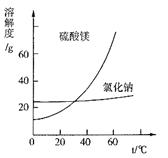
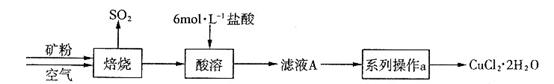

 CuCl42-(黄色)+4H2O。
CuCl42-(黄色)+4H2O。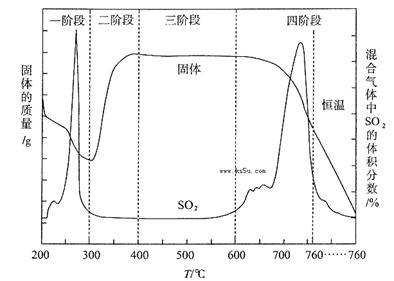
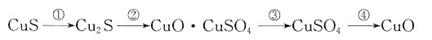

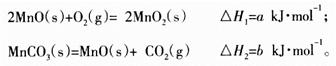
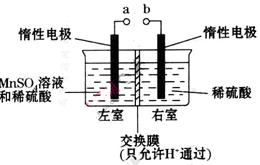
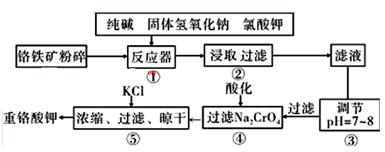
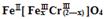 (铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4 • 7H2O,下列结论正确的是_______。
(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4 • 7H2O,下列结论正确的是_______。 粤公网安备 44130202000953号
粤公网安备 44130202000953号