已知NaHSO4在水中的电离方程式为:NaHSO4==Na++H++SO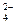 。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是( )
。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是( )
| A.该温度高于25℃ |
| B.由水电离出来的H+的浓度是1.0×10-12mol·L-1 |
| C.加入NaHSO4晶体抑制了水的电离 |
| D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性 |
已知NaHSO4在水中的电离方程式为:NaHSO4==Na++H++SO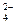 。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是( )
。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是( )
| A.该温度高于25℃ |
| B.由水电离出来的H+的浓度是1.0×10-12mol·L-1 |
| C.加入NaHSO4晶体抑制了水的电离 |
| D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性 |