下面列出了几组物质,请将物质的合适序号填写在空格上。
互为同位素的是 ,互为同系物的是 ,互为同分异构体的是 。
①金刚石与“足球烯”C60; ②D与T; ③16O、17O和18O;
④氧气(O2)与臭氧(O3); ⑤CH4和CH3CH2CH3;
⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3);
|
CH3
⑦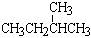 和 CH3-C-CH3
和 CH3-C-CH3
|
下面列出了几组物质,请将物质的合适序号填写在空格上。
互为同位素的是 ,互为同系物的是 ,互为同分异构体的是 。
①金刚石与“足球烯”C60; ②D与T; ③16O、17O和18O;
④氧气(O2)与臭氧(O3); ⑤CH4和CH3CH2CH3;
⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3);
|
CH3
⑦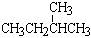 和 CH3-C-CH3
和 CH3-C-CH3
|