A、B、C、D为前四周期元素。A元素的原子价电子排布为ns2np2,B元素原子的最外层电子数是其电子层数的3倍,C元素原子的M能层的p能级有3个未成对电子,D元素原子核外的M能层中只有2对成对电子。
请回答下列问题:
(1)当n=2时,AB2属于 分子(填“极性”或“非极性”),分子中
有 个σ键、 个π键。
(2)当n=3时,A与B形成的晶体属于 晶体。
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种原子的电负性由大到小的顺序是 (用元素符号表示)。
(4)已知某红紫色配合物的组成为CoCl3·5NH3·H2O。该配合物中的中心离子钴离子在基态时的核外电子排布式为 ,作为配位体之一的NH3分子的空间构型为 。
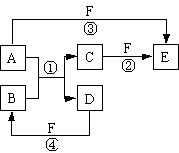
 C2Ex。请写出电池放电时正负极的电极反应式,正极反应式:_______________________。用该电池作电源进行电解含有0.2 mol CuSO4和0.2 mol NaCl的混合溶液500 mL时:若此电池工作一段时间后消耗23 g C单质。则阳极产生气体体积为:________L(标准状况下);电解后溶液加水稀释至2 L ,溶液的pH为:________。
C2Ex。请写出电池放电时正负极的电极反应式,正极反应式:_______________________。用该电池作电源进行电解含有0.2 mol CuSO4和0.2 mol NaCl的混合溶液500 mL时:若此电池工作一段时间后消耗23 g C单质。则阳极产生气体体积为:________L(标准状况下);电解后溶液加水稀释至2 L ,溶液的pH为:________。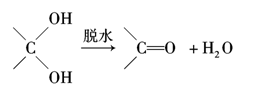

 粤公网安备 44130202000953号
粤公网安备 44130202000953号