已知A、B、C、D是中学化学中常见的四种不同微粒,它们之间存在如图所示的转化关系.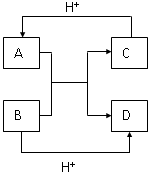
(1)如果A、B是10电子离子,C、D是10电子分子,A、B、C、D均含有两种元素.请写出A、B的电子式:
A 、B 、C、D的化学式 C 、D .
(2)写出A离子与B反应的离子方程式: .
已知A、B、C、D是中学化学中常见的四种不同微粒,它们之间存在如图所示的转化关系.
(1)如果A、B是10电子离子,C、D是10电子分子,A、B、C、D均含有两种元素.请写出A、B的电子式:
A 、B 、C、D的化学式 C 、D .
(2)写出A离子与B反应的离子方程式: .