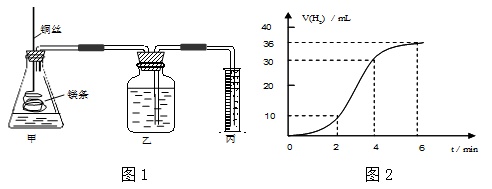
|
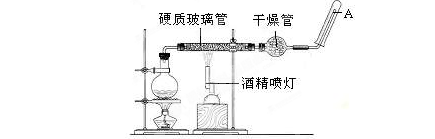
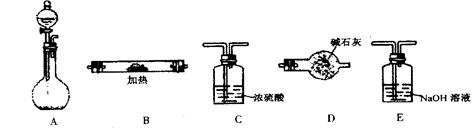
实验室制取气体常用的装置如下列图示,请回答下列问题:(选用装置时填字母编号)

(1)若实验室选用装置C制取氨气,则反应的化学方程式为
________________________________________
 ______________________,
______________________,检验NH3收
 满的方法:____________________________________________________;
满的方法:____________________________________________________;(2)若实验室利用过氧化钠与水反应制取氧气,则应选择__________装置,有关反应的化学方程式为:________________________________________________。

 。
。

 l2有无漂白性。
l2有无漂白性。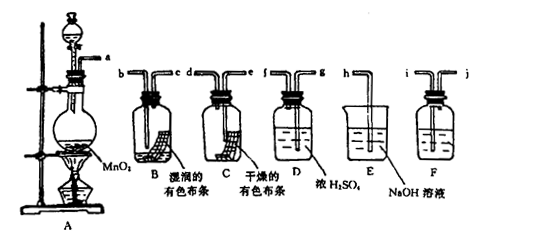
 。
。 红色布条的现象可得出的结论是
红色布条的现象可得出的结论是 填序号)。
填序号)。
 操作是。
操作是。 连接顺序是(填字母)( )→(
连接顺序是(填字母)( )→(  )→( )→E
)→( )→E 粤公网安备 44130202000953号
粤公网安备 44130202000953号