下表为元素周期表的一部分。表中所列的字母分别代表某一元素。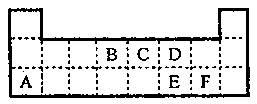
(1)元素F的名称是_____________;
(2)B、C、D、E四种元素的氢化物中最稳定的是____________(写化学式);
(3)写出B的最高价氧化物的电子式 ________;
(4)1molA与D的氢化物完全反应产生的气体在标准状况下的体积为 。
下表为元素周期表的一部分。表中所列的字母分别代表某一元素。
(1)元素F的名称是_____________;
(2)B、C、D、E四种元素的氢化物中最稳定的是____________(写化学式);
(3)写出B的最高价氧化物的电子式 ________;
(4)1molA与D的氢化物完全反应产生的气体在标准状况下的体积为 。