(10分)硫酸铵是一种常用的铵态氮肥。下表是硫酸铵化肥品质的主要指标。
指标
项目
|
优等品
|
一等品
|
合格品
|
外观
|
白色结晶,无可见机械杂质
|
无可见机械杂质
|
氮(N)含量
|
≥21.0%
|
≥21.0%
|
≥20. 5%
|
新华中学化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究。
[观察外观] 该硫酸铵化肥无可见机械杂质。
[实验探究]按右图所示装置进行实验。
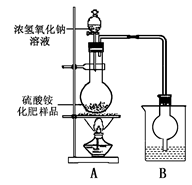
(1)烧瓶内发生反应的离子方程式为:_________________________________________________
烧杯中盛放的试剂最好是 ___ __(填“浓硫酸”、“稀硫酸”或“水”)。
(2)实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热的原因是_________________________________。
[交流讨论]
甲同学:根据此实验测得的数据,计算硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:__________________________________________________。
乙同学:实验装置中还存在另一个明显缺陷是:___________________________________________________________________________________________________。
经过大家充分讨论一致认为:针对甲、乙两位同学指出的实验装置中存在的明显缺陷,需改进实验装置,重新进行实验。
[探究结论]
称取13.5 g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验前后B装置增重3.40 g。该化肥(填“是”或“不是”)一等品。