(1)某烷烃含有200个氢原子,那么该饱和烃的分子式是 。
(2)辛烷的分子式为 。
(3)A~D是几种烃分子的球棍模型,据此回答下列问题: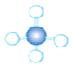
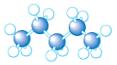
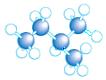
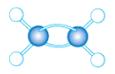
A B C D
则:C的结构简式为 。与B、C互为同分异构体的另一有机物的结构简式为
(1)某烷烃含有200个氢原子,那么该饱和烃的分子式是 。
(2)辛烷的分子式为 。
(3)A~D是几种烃分子的球棍模型,据此回答下列问题:



A B C D
则:C的结构简式为 。与B、C互为同分异构体的另一有机物的结构简式为