(1)①25 ℃时,将20 mL 0.1 mol·L-1CH3COOH溶液和20 mL 0.1 mol·L-1 HSCN溶液分别与20 mL 0.1 mol·L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示。反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 。
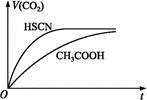
反应结束后所得两溶液中,c(CH3COO-) c(SCN-)(填“>”“<”或“=”)。
②若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是 (填序号)。
| A.c(CH3COO-) |
B.c(H+) |
C.KW |
D.醋酸电离平衡常数 |
E.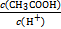
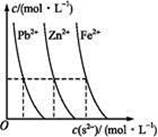
(2)下图为某温度下,PbS(s).ZnS(s).FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度.金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是 (填化学式)。向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+.Fe2+的溶液,振荡后,ZnS沉淀会转化为 (填化学式)沉淀。
(3)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10 mL 0.01 mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系 ,c(H2C2O4) c(C2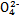 )(填“<”“>”或“=”)。
)(填“<”“>”或“=”)。