(12分) 如下图所示,在一个烧瓶中充满气体A,打开①处的止水夹向烧瓶中缓慢通入等体积的气体B后关闭该止水夹,待充分反应后再打开②处的止水夹。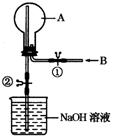
(1)请按要求填表回答打开②处的止水夹前烧瓶中所观察到的现象并按要求书写反应的化学方程式: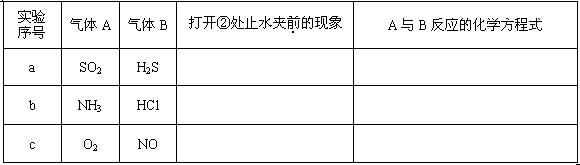
(2) 打开②处的止水夹后,烧瓶内剩余气体最多的是(填实验序号)____________。
(12分) 如下图所示,在一个烧瓶中充满气体A,打开①处的止水夹向烧瓶中缓慢通入等体积的气体B后关闭该止水夹,待充分反应后再打开②处的止水夹。
(1)请按要求填表回答打开②处的止水夹前烧瓶中所观察到的现象并按要求书写反应的化学方程式:
(2) 打开②处的止水夹后,烧瓶内剩余气体最多的是(填实验序号)____________。