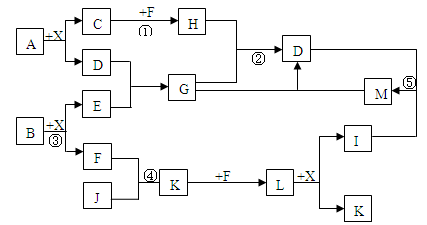
M为一种常见的液体试剂。下列物质在一定条件下可发生如下图所示的转化关系。
回答下列问题:
⑴写出淡黄色粉末和M反应的化学方程式
⑵若固体乙是硫化铝,则:
①C化学式是 ,G的化学式是 ;
②H溶解于A溶液的离子方程式是 ;
⑶若白色沉淀D不能溶解于A溶液,气体C能使湿润的试纸变蓝,则固体乙的化学式可能是

 短周期主族元素A、B、C、D、E在元素周期表中的位置如下图所示,其中A为地壳中含量最高的金属元素。
短周期主族元素A、B、C、D、E在元素周期表中的位置如下图所示,其中A为地壳中含量最高的金属元素。
 (在水溶液中进行)。其中C是产生温室效应的气体;D是淡黄色固体。写出C的结构式 ;D的电子式
(在水溶液中进行)。其中C是产生温室效应的气体;D是淡黄色固体。写出C的结构式 ;D的电子式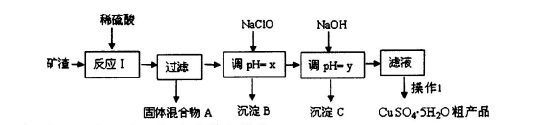
 粤公网安备 44130202000953号
粤公网安备 44130202000953号