某共价化合物含 C 、 H 、 N三元素 , 分子内有 4 个 N 原子 , 且 4 个 N 原子排列成内空的四面体 ( 如白磷分子结构 ), 每两个 N 原子间都有一个 C 原子 , 分子内无C-C单键和C=C双键。
(1) 试确定该化合物的分子式_____________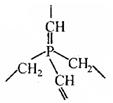
(2) 假若某大分子 , 分子内只含 C 、 H 、 P 二种元素 , 其最小的重复的结构单元如上图当该化合物分子中含n个磷原子时,则该化合物的组成可表示为____________________。
某共价化合物含 C 、 H 、 N三元素 , 分子内有 4 个 N 原子 , 且 4 个 N 原子排列成内空的四面体 ( 如白磷分子结构 ), 每两个 N 原子间都有一个 C 原子 , 分子内无C-C单键和C=C双键。
(1) 试确定该化合物的分子式_____________
(2) 假若某大分子 , 分子内只含 C 、 H 、 P 二种元素 , 其最小的重复的结构单元如上图当该化合物分子中含n个磷原子时,则该化合物的组成可表示为____________________。