下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
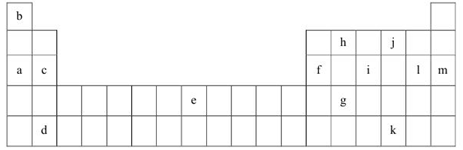
(1)上述元素的单质可能是电的良导体的是_______(填字母代号)。
(2)下表是一些气态原子的第一、二、三、四级电离能(kJ·mol-1):
|
锂
|
X
|
Y
|
第一电离能
|
519
|
502
|
580
|
第二电离能
|
7296
|
4570
|
1820
|
第三电离能
|
11799
|
6920
|
2750
|
第四电离能
|
|
9550
|
11600
|
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量: 。
②表中的Y可能为以上13种元素中的 (填元素符号)元素,用元素符号表示X和j按原子个数1:1形成化合物的电子式 。
(3)根据构造原理,用电子排布式表示e的核外电子排布式 。
(4)以上13种元素中, (填元素符号)元素原子失去核外第一个电子需要的能量最多。
(5)a、e、f三种元素的最高价氧化物的水化物显碱性,其碱性最强的为_______(用化学符号作答)。f的氧化物具有两性,写出其与NaOH溶液反应的离子方程式___________。