已知: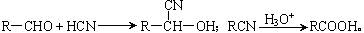
某企业合成高效、低毒农药杀灭菊酯的路线如下: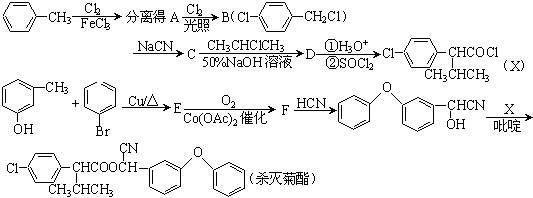
(1)写出下列物质的结构简式:
C______________;D______________;E______________;F______________。
(2)从甲苯到D的四步反应中有________步是取代反应。
(3)农药杀灭菊酯的分子式为__________________。
(4)写出E→F的化学方程式____________________________________。
已知: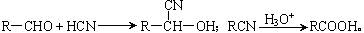
某企业合成高效、低毒农药杀灭菊酯的路线如下:
(1)写出下列物质的结构简式:
C______________;D______________;E______________;F______________。
(2)从甲苯到D的四步反应中有________步是取代反应。
(3)农药杀灭菊酯的分子式为__________________。
(4)写出E→F的化学方程式____________________________________。