烯烃A在一定条件下可以按下图所示进行反应: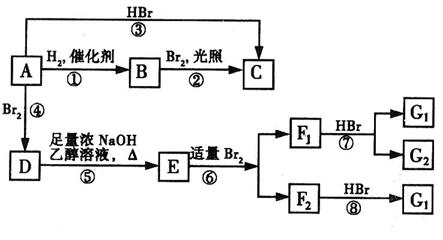
(D是 ,
,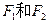 互为同分异构体,
互为同分异构体,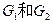 互为同分异构体。)
互为同分异构体。)
请回答下列问题:
(1)A的结构简式是 ▲ ;G1的结构简式是 ▲ 。
(2)用系统命名法命名有机物B,B的名称是 ▲ 。
(3)框图中属于取代反应的是 ▲ 。(填数字代号)
(4)E→F2的化学反应方程式 ▲ ,属于 ▲ 反应。
烯烃A在一定条件下可以按下图所示进行反应:
(D是 ,
,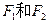 互为同分异构体,
互为同分异构体,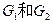 互为同分异构体。)
互为同分异构体。)
请回答下列问题:
(1)A的结构简式是 ▲ ;G1的结构简式是 ▲ 。
(2)用系统命名法命名有机物B,B的名称是 ▲ 。
(3)框图中属于取代反应的是 ▲ 。(填数字代号)
(4)E→F2的化学反应方程式 ▲ ,属于 ▲ 反应。