烷基取代苯( )可以被酸性KMnO4溶液氧化生成
)可以被酸性KMnO4溶液氧化生成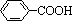 ,但若烷基R中直接与苯环连接的碳原子没有C—H键,则不容易被氧化得到
,但若烷基R中直接与苯环连接的碳原子没有C—H键,则不容易被氧化得到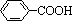 。现有分子式是C11H16的烷基一取代苯,则它可以被氧化成为
。现有分子式是C11H16的烷基一取代苯,则它可以被氧化成为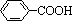 的同分异构体共有 ▲ 种,并写出一种不能被氧化成为
的同分异构体共有 ▲ 种,并写出一种不能被氧化成为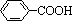 的同分异构体的结构简式 ▲ 。
的同分异构体的结构简式 ▲ 。
烷基取代苯( )可以被酸性KMnO4溶液氧化生成
)可以被酸性KMnO4溶液氧化生成 ,但若烷基R中直接与苯环连接的碳原子没有C—H键,则不容易被氧化得到
,但若烷基R中直接与苯环连接的碳原子没有C—H键,则不容易被氧化得到 。现有分子式是C11H16的烷基一取代苯,则它可以被氧化成为
。现有分子式是C11H16的烷基一取代苯,则它可以被氧化成为 的同分异构体共有 ▲ 种,并写出一种不能被氧化成为
的同分异构体共有 ▲ 种,并写出一种不能被氧化成为 的同分异构体的结构简式 ▲ 。
的同分异构体的结构简式 ▲ 。