化学在能源开发与利用中起到十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
Ⅰ (1)在298K、101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量。则表示氢气燃烧热的热化学方程式为: 。
氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行下图饱和食盐水电解实验(图中所用电极均为惰性电极)。分析该装置、回答下列问题:
(2)氢氧燃料电池中,a电极为电池的是 (填“正极”或“负极”),气体M的分子式 ,a电极上发生的电极反应式为: 。
(3)若右上图装置中盛有100mL5.0mol/LNaCl溶液,电解一段时间后须加入10.0mol/L盐酸溶液50mL(密度为1.02g/mL)才能使溶液恢复至原来状态。则在此电解过程中导线上转移的电子数为 mol。(保留小数点后2位)
Ⅱ 氢气是合成氨的重要原料。工业上合成氨的反应是:
N2(g)+3H2(g) 2NH3 (g) ΔH=-92.2kJ·mol-1
2NH3 (g) ΔH=-92.2kJ·mol-1
(4)下列事实中,不能说明上述可逆反应已经达到平衡的是 。
① N2、H2、NH3的体积分数不再改变;
② 单位时间内生成2n mol NH3的同时生成3n mol H2;
③ 单位时间内生成3n mol N—H键的同时生成n mol N≡N;
④ 用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2;
⑤ 混合气体的平均摩尔质量不再改变;
⑥ 混合气体的总物质的量不再改变。
(5)已知合成氨反应在某温度下2.00L的密闭容器中反应,测得如下数据:
根据表中数据计算:
①反应进行到2小时时放出的热量为 kJ。
②0~1小时内N2的平均反应速率 mol·L-1·h-1。
③此条件下该反应的化学平衡常数K== (保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1 mol,化学平衡向 方向移动(填“正反应”或“逆反应”或“不移动”。)

 (1)步骤1的主要操作是,需用到的玻璃仪器除烧杯外有。
(1)步骤1的主要操作是,需用到的玻璃仪器除烧杯外有。
 时间置于空气中,表面“发黄”,请用化学方程式表示原因。
时间置于空气中,表面“发黄”,请用化学方程式表示原因。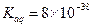 试计算该物质沉淀完全所需要的pH=(要求保留2位有效数字)(已知溶液中离子浓度小于10-5mol/L时,该离子可看做沉淀完全,lg2=0.3)
试计算该物质沉淀完全所需要的pH=(要求保留2位有效数字)(已知溶液中离子浓度小于10-5mol/L时,该离子可看做沉淀完全,lg2=0.3) 粤公网安备 44130202000953号
粤公网安备 44130202000953号