某温度下,某容积恒定的密闭容器中发生如下可逆反应:
CO(g)+H2O(g)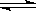 H2(g)+CO2(g) △H>0
H2(g)+CO2(g) △H>0
当反应达平衡时,测得容器中各物质均为n mol,欲使H2的平衡浓度增大一倍,在其它条件不变时,下列措施可以采用的是:
| A.升高温度 | B.加入催化剂 |
| C.再加入n mol CO和n mol H2O | D.再加入2n mol CO2和2n mol H2 |
某温度下,某容积恒定的密闭容器中发生如下可逆反应:
CO(g)+H2O(g)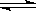 H2(g)+CO2(g) △H>0
H2(g)+CO2(g) △H>0
当反应达平衡时,测得容器中各物质均为n mol,欲使H2的平衡浓度增大一倍,在其它条件不变时,下列措施可以采用的是:
| A.升高温度 | B.加入催化剂 |
| C.再加入n mol CO和n mol H2O | D.再加入2n mol CO2和2n mol H2 |