(6分)石油通过裂化和裂解可以得到乙烯,乙烯的产量可以用来衡量一个国家石油化工发展水平。下图是由乙烯为原料生产某些化工产品的转化关系图。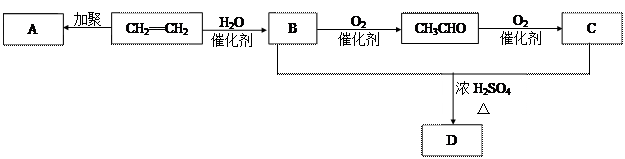
据此回答下列问题。
(1)写出乙烯的一种用途__ _____,指出乙烯→B的反应类型 (选填取代反应或加成反应)。
(2)写出A的结构简式__________________。
(3)写出B + C → D的化学反应方程式______________ _____________________。
(6分)石油通过裂化和裂解可以得到乙烯,乙烯的产量可以用来衡量一个国家石油化工发展水平。下图是由乙烯为原料生产某些化工产品的转化关系图。
据此回答下列问题。
(1)写出乙烯的一种用途__ _____,指出乙烯→B的反应类型 (选填取代反应或加成反应)。
(2)写出A的结构简式__________________。
(3)写出B + C → D的化学反应方程式______________ _____________________。