已知乙烯能发生以下转化: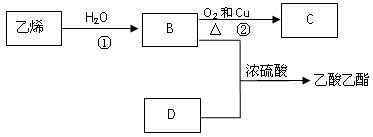
(1)乙烯的结构简式为:
(2)图中浓硫酸所起作用是______________________
(3)写出反应的化学方程式
①: 反应类型:
②: 反应类型:
已知乙烯能发生以下转化:
(1)乙烯的结构简式为:
(2)图中浓硫酸所起作用是______________________
(3)写出反应的化学方程式
①: 反应类型:
②: 反应类型: