、(1)有机化合物的结构简式可进一步简化,如:
写出下列物质的分子式:
①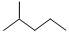 分子式 用系统命名法对该有机物进行命名_______________
分子式 用系统命名法对该有机物进行命名_______________
② 分子式 ③
分子式 ③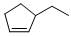 分子式
分子式
(2)除去下列物质中的杂质(括号内为杂质),填入所用试剂和分离方法。
①乙烯(SO2),试剂 ,分离方法
②苯(溴),试剂 ,分离方法
、(1)有机化合物的结构简式可进一步简化,如:
写出下列物质的分子式:
① 分子式 用系统命名法对该有机物进行命名_______________
分子式 用系统命名法对该有机物进行命名_______________
② 分子式 ③
分子式 ③ 分子式
分子式
(2)除去下列物质中的杂质(括号内为杂质),填入所用试剂和分离方法。
①乙烯(SO2),试剂 ,分离方法
②苯(溴),试剂 ,分离方法