(4分)将下列物质进行分类(填序号)
① O2与O3 ②126C与136C ③金刚石与石墨 ④冰与水 ⑤ H2、D2、T2
⑥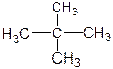 和
和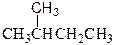
(1)互为同位素的是 (2)互为同素异形体的是
(3)互为同分异构体的是 (4)属于同一化合物的是
(4分)将下列物质进行分类(填序号)
① O2与O3 ②126C与136C ③金刚石与石墨 ④冰与水 ⑤ H2、D2、T2
⑥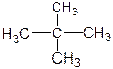 和
和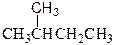
(1)互为同位素的是 (2)互为同素异形体的是
(3)互为同分异构体的是 (4)属于同一化合物的是