A、B、C、D、E五种芳香族化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料。它们的结构简式如下所示:
A.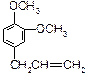 B.
B. C.
C.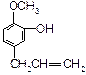 D.
D. E.
E.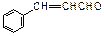
请回答下列问题:
(1)这五种化合物中,互为同分异构体的是 (写编号)。
(2)D中含有的官能团是(写结构简式):
A、B、C、D、E五种芳香族化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料。它们的结构简式如下所示:
A.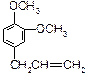 B.
B. C.
C.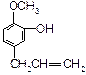 D.
D. E.
E.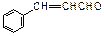
请回答下列问题:
(1)这五种化合物中,互为同分异构体的是 (写编号)。
(2)D中含有的官能团是(写结构简式):