化合物A是一种不稳定的物质,它的分子组成可用 表示,10mL A气体能分解生成15 mL
表示,10mL A气体能分解生成15 mL 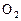 和10mL
和10mL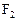 (同温同压下)
(同温同压下)
(1)A的分子式___________________;
(2)已知A分子中X个氧原子是…—O—O—O—…链状排列,则A分子的电子式____________________,结构式是_____________________。
化合物A是一种不稳定的物质,它的分子组成可用 表示,10mL A气体能分解生成15 mL
表示,10mL A气体能分解生成15 mL 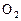 和10mL
和10mL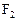 (同温同压下)
(同温同压下)
(1)A的分子式___________________;
(2)已知A分子中X个氧原子是…—O—O—O—…链状排列,则A分子的电子式____________________,结构式是_____________________。