(14分)黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取硫酸的主要原料。某化学学习小组对某黄铁矿石进行如下实验探究。
[实验一]测定硫元素的含量。
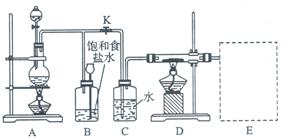
Ⅰ、将m1 g该黄铁矿样品放入如图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2 + 11O2 2Fe2O3 + 8SO2
2Fe2O3 + 8SO2

Ⅱ、反应结束后,将乙瓶中的溶液进行如下处理:

|
[实验二]测定铁元素的含量。
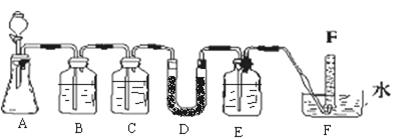
III、测定铁元素含量的实验步骤如图所示。
问题讨论:
(1)I中,甲瓶内所盛试剂是________溶液。乙瓶内发生反应的离子方程式有______
___________。
(2)II中,所加H2O2溶液(氧化剂)需足量的理由是__________。
(3)该黄铁矿中硫元素的质量分数为__________。
(4)III的步骤②中,若选用铁粉作还原剂,你认为合理吗?_______,理由是:_______。
(5)III的步骤③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_________。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号