(每空2分,共10分)
卤代烃分子里的卤原子与活泼金属阳离子结合,发生下列反应(X表示卤原子):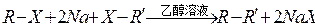

根据下图所示转化关系,完成下列填空: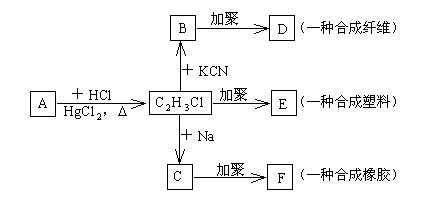
(1)A的分子式是 ,B的结构简式是 ,
E的结构简式是 ,
(2)B→D的化学方程式是 。
(3)C→F的化学方程式是 。
(每空2分,共10分)
卤代烃分子里的卤原子与活泼金属阳离子结合,发生下列反应(X表示卤原子):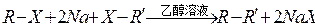

根据下图所示转化关系,完成下列填空:
(1)A的分子式是 ,B的结构简式是 ,
E的结构简式是 ,
(2)B→D的化学方程式是 。
(3)C→F的化学方程式是 。