可逆反应A(气)+B(气) 3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:
3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系: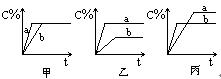
(1)若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则___ 曲线是表示有催化剂时的情况。
(2)若乙图中的a曲线表示200℃和b曲线表示100℃时的情况,则此可逆反应的正反应是_____ 热反应。
(3)若丙图中两条曲线分别表示不同压强下的情况,则____ 曲线是表示压强较大的情况。
可逆反应A(气)+B(气) 3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:
3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:
(1)若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则___ 曲线是表示有催化剂时的情况。
(2)若乙图中的a曲线表示200℃和b曲线表示100℃时的情况,则此可逆反应的正反应是_____ 热反应。
(3)若丙图中两条曲线分别表示不同压强下的情况,则____ 曲线是表示压强较大的情况。