海水中有丰富的化学资源,从海水中可提取多种化工原料,下图是海水综合利用——合成氨——纯碱的联合生产工艺流程: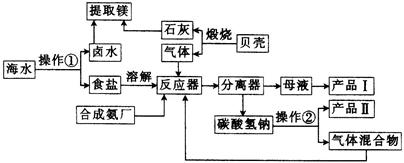
(1)写出反应器中发生反应的化学方程式: 。
(2)分离器中进行的操作名称是 ,图中操作①是 。
(3)产品Ⅱ是 (填化学 式)。
式)。
(4)写出合成氨厂里用天然气和水蒸气在催化剂和高温下反应制备原料气H2的化学方程式: 。
(5)设计用卤水和石灰及其他必要试剂提取镁的过程:(用化学方程式表示)。
海水中有丰富的化学资源,从海水中可提取多种化工原料,下图是海水综合利用——合成氨——纯碱的联合生产工艺流程:
(1)写出反应器中发生反应的化学方程式: 。
(2)分离器中进行的操作名称是 ,图中操作①是 。
(3)产品Ⅱ是 (填化学 式)。
式)。
(4)写出合成氨厂里用天然气和水蒸气在催化剂和高温下反应制备原料气H2的化学方程式: 。
(5)设计用卤水和石灰及其他必要试剂提取镁的过程:(用化学方程式表示)。