在一定条件下,可逆反应A(g)+B(g) 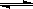 2C(g)达到了化学平衡状态,经测得平衡时c(A)=0.5mol•L-1,c(B)=0.1mol•L-1,c(C) =1.6mol•L-1,若A、B、C的起始浓度分别以amol•L-1,bmol•L-1,cmol•L-1表示,请回答:
2C(g)达到了化学平衡状态,经测得平衡时c(A)=0.5mol•L-1,c(B)=0.1mol•L-1,c(C) =1.6mol•L-1,若A、B、C的起始浓度分别以amol•L-1,bmol•L-1,cmol•L-1表示,请回答:
(1)a、b应满足的关系是_________。
(2)a的取值范围是_________。
在一定条件下,可逆反应A(g)+B(g) 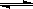 2C(g)达到了化学平衡状态,经测得平衡时c(A)=0.5mol•L-1,c(B)=0.1mol•L-1,c(C) =1.6mol•L-1,若A、B、C的起始浓度分别以amol•L-1,bmol•L-1,cmol•L-1表示,请回答:
2C(g)达到了化学平衡状态,经测得平衡时c(A)=0.5mol•L-1,c(B)=0.1mol•L-1,c(C) =1.6mol•L-1,若A、B、C的起始浓度分别以amol•L-1,bmol•L-1,cmol•L-1表示,请回答:
(1)a、b应满足的关系是_________。
(2)a的取值范围是_________。