实验室制备甲酸铜晶体[Cu(HCOO)2·4H2O]的流程如下: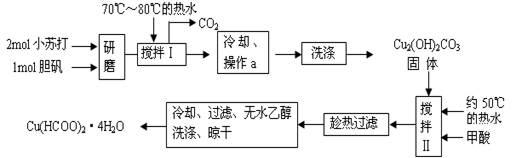
回答下列问题:
(1)生成碱式碳酸铜[Cu2(OH)2CO3]的离子方程式为 。
(2)操作a的名称是 ,该操作使用的玻璃仪器有 。
(3)证明碱式碳酸铜沉淀已经洗涤充分的实验操作是 ;“趁热过滤”的原因是 ;
(4)用无水乙醇洗涤晶体的目的是 。
实验室制备甲酸铜晶体[Cu(HCOO)2·4H2O]的流程如下:
回答下列问题:
(1)生成碱式碳酸铜[Cu2(OH)2CO3]的离子方程式为 。
(2)操作a的名称是 ,该操作使用的玻璃仪器有 。
(3)证明碱式碳酸铜沉淀已经洗涤充分的实验操作是 ;“趁热过滤”的原因是 ;
(4)用无水乙醇洗涤晶体的目的是 。