市售氯化钾中所含杂质以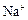 和
和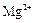 为主,也含有少量
为主,也含有少量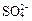 、
、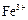 等。提纯过程如下:
等。提纯过程如下:
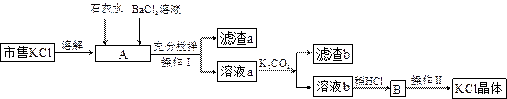
(1)操作I所用的玻璃仪器有 ;操作II的主要步骤是 。
(2)滤渣b的主要成分是 。
(3)检验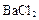 溶液是否加入过量,其详细操作过程为 。
溶液是否加入过量,其详细操作过程为 。
(4)产品KCl晶体可能仍含少量的NaCl,检验的方法是 ,进一步提纯的方法是 。
市售氯化钾中所含杂质以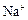 和
和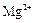 为主,也含有少量
为主,也含有少量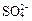 、
、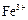 等。提纯过程如下:
等。提纯过程如下:
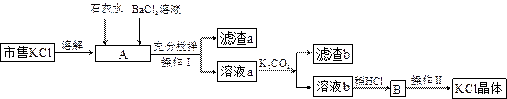
(1)操作I所用的玻璃仪器有 ;操作II的主要步骤是 。
(2)滤渣b的主要成分是 。
(3)检验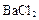 溶液是否加入过量,其详细操作过程为 。
溶液是否加入过量,其详细操作过程为 。
(4)产品KCl晶体可能仍含少量的NaCl,检验的方法是 ,进一步提纯的方法是 。