已知A、B、 C、 D四种物质都含有一种共同的元素,相互转化的关系如图所示:
其中,A是一种淡黄色的固态非金属单质,B是H2S,C是一种无色有刺激性气味的气体,并能使品红溶液褪色,D是H2SO4。
(1)根据以上信息推断:A: C: (填化学式)
(2)从A、 B、 C、 D四种物质中任选一种,从他们所含共同元素的价态上预测该物质具有氧化性或还原性,并设计实验验证:
我的预测:
主要操作:
可能的现象:
化学方程式:
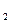 H
H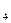 )和强氧化剂H
)和强氧化剂H C(g)△H<0。达到平衡时,C的体积分数为40%。试回答有关问题:
C(g)△H<0。达到平衡时,C的体积分数为40%。试回答有关问题: 到平衡时,C的体积分数为_____________,容器的容积为_____________。
到平衡时,C的体积分数为_____________,容器的容积为_____________。 2SO3(g) , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,用O2浓度变化来表示的反应速率为 __________________。
2SO3(g) , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,用O2浓度变化来表示的反应速率为 __________________。
 2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是___________________; 请将增大压
2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是___________________; 请将增大压 强时的反应速率变化情况画在c~d处:
强时的反应速率变化情况画在c~d处: CO(g)+H2O(g),
CO(g)+H2O(g), C(g)
C(g) ,达到平衡后,生成a mol C,这时A的物质的量为_________mol。
,达到平衡后,生成a mol C,这时A的物质的量为_________mol。 粤公网安备 44130202000953号
粤公网安备 44130202000953号