超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO+2CO 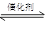 2CO2+N2
2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
时间/s
|
0
|
1
|
2
|
3
|
4
|
5
|
c(NO)/
mol·L-1
|
1.00×10-3
|
4.50×10-4
|
2.50×10-4
|
1.50×10-4
|
1.00×10-4
|
1.00×10-4
|
c(CO)/
mol·L-1
|
3.60×10-3
|
3.05×10-3
|
2.85×10-3
|
2.75×10-3
|
2.70×10-3
|
2.70×10-3
|
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)写出该反应的平衡常数表达式K=。
(2)前2s内的平均反应速率v(N2)=_____________。
(3)在上述条件下反应能够自发进行,则反应的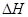 0(填写“>”、“<”、“=”)。
0(填写“>”、“<”、“=”)。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中,请在表格中填入剩余的实验条
件数据。
实验编号
|
T/℃
|
NO初始浓度
mol·L-1
|
CO初始浓度
mol·L-1
|
催化剂的比表面积
㎡·g-1
|
Ⅰ
|
280
|
1.2×10-3
|
5.8×10-3
|
82
|
Ⅱ
|
|
|
5.8×10-3
|
124
|
Ⅲ
|
350
|
1.2×10-3
|
|
|