某化肥厂氨和空气(设氧气的体积分数为0.2,空气式量为29)生产硝酸铵过程如下: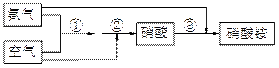

其中①、②的反应方程式为:4NH3 + 5O2 ——→ 4NO+6H2O, 4NO+3O2+2H2O → 4HNO3
(1)若原料气的密度为1.25g/L(标准状况),则氨气与空气的体积比_________。
(2)若生产硝酸的氨气与空气中的氧气恰好完全反应,且硝酸全部溶解反应产生的水中,所得硝酸溶液的物质的量浓度为____________(保留2位小数,此时硝酸溶液的密度为1.38g/cm3)。
(3)若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中氨气(包含第③步被硝酸吸收的氨气)的体积分数最大值为____________。
(4)若实际生产中,反应①的转化率为94%,反应②的转化率为97%,反应③中氨的转化率为98%,硝酸完全转化。求(写出计算过程):
(i)100 m3(已折算到标准状况)氨气最多可生产硝酸铵的质量(kg)。
(ii)合成硝酸铵的整个流程中,氨的总转化率。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号