利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g)="2NO(g) " △H=+180.5kJ/mol
N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mo
若有17g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为 。
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g) 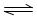
2NH3(g)反应的影响。实验结果如图所示:(图中T表示温度,n表示物质的量)
①图像中T2和T1的关系是:T2 T2(填“高于”“低于”“等于”“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 (填字母)。
③在起始体系中加入N2的物质的量为 mol时,反应后氨的百分含量最大。若容器容积为H,n=3mol反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K= 。
(3)N2O3是一种新型硝化剂,其性质和制备受到人们的关注。
①一定温度下,在恒容密闭容器中N2O3可发生下列反应:
2N2O3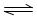 4NO2(g)+O2△H>0下表为反应在T1温度下的部分实验数据
4NO2(g)+O2△H>0下表为反应在T1温度下的部分实验数据
| Vs |
0 |
500 |
1000 |
| c(N2O3)/mol·L-1 |
5.00 |
3.52 |
2.48 |
则500s内NO2的平均生成速率为 .
②现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O3,装置如图所示,其中Y为CO2。
写出石墨I电极上发生反应的电极反应式 。
在电解池中生成N2O3的电极反应式为 。
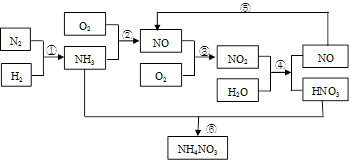
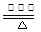 ____NO+ ________
____NO+ ________  CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:

 粤公网安备 44130202000953号
粤公网安备 44130202000953号