已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H)。右图为氧族元素氢化物a、b、c、d的生成热数据示意图。试回答下列问题: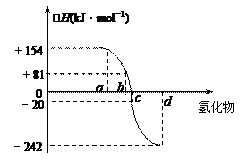
(1)写出氧族元素中含有18e-的两种氢化物的电子式 、 。
(2)请你归纳:非金属元素氢化物的稳定性与氢化物的生成热△H的关系
(3)写出硒化氢在热力学标准态下,发生分解反应的热化学反应方程式:
已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H)。右图为氧族元素氢化物a、b、c、d的生成热数据示意图。试回答下列问题: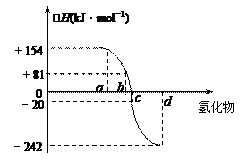
(1)写出氧族元素中含有18e-的两种氢化物的电子式 、 。
(2)请你归纳:非金属元素氢化物的稳定性与氢化物的生成热△H的关系
(3)写出硒化氢在热力学标准态下,发生分解反应的热化学反应方程式: