常温下,取pH="2" 的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是 ( )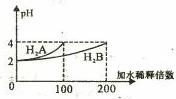
A.H2A为二元弱酸
B.稀释前c(H2B)>c(H2A)="0.01mol" /L
C.pH=3的NaHA水溶液中,离子浓度大小为
c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)
D.Na2B的水溶液中,离子浓度大小为c(Na+)>c(B2-)>c(OH-)>c(H+)
常温下,取pH="2" 的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是 ( )
A.H2A为二元弱酸
B.稀释前c(H2B)>c(H2A)="0.01mol" /L
C.pH=3的NaHA水溶液中,离子浓度大小为
c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)
D.Na2B的水溶液中,离子浓度大小为c(Na+)>c(B2-)>c(OH-)>c(H+)