感冒是一种常见的病,人患了感冒会咳嗽、流涕、发烧,多喝开水多休息,适当服用一些治疗感冒的药,可以舒缓症状,减轻病情。
(1)药物阿司匹林是一种传统的治疗感冒发烧的老药,从分子结构上看,它可以看作是乙酸酯,其结构简式如右图: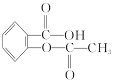
作为一种解热镇痛药,对于感冒发烧,它有较好的疗效,但大剂量长期空腹服用,容易对胃肠道产生刺激,原因是阿司匹林在胃中会发生酯的水解反应,生成_________和_________(用结构简式表示),阿司匹林分子水解后,能电离出氢离子(H+)的官能团增多,增大了对胃肠道的刺激。
(2)为减小副作用,一般宜饭后服药,并同时服用少量辅助药物,在①硫酸镁、②氢氧化钡、③碳酸钙中选取哪一种?


 侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:
侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:


 粤公网安备 44130202000953号
粤公网安备 44130202000953号