某种豆类作物中所含的天然蛋白质在酶的作用下发生水解,可得到甲、乙两种氨基酸。已知甲的结构简式为: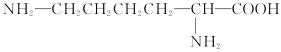 ,乙的分子式为C4H7O4N。
,乙的分子式为C4H7O4N。
(1)由甲形成的三肽中氨基、羧基的数目依次为__________、__________。
(2)若乙不能发生银镜反应,其分子中没有甲基,则乙的结构简式为____________________。
(3)乙的分子中的—NH2和—COOH发生分子内缩合反应脱去一分子水,所形成的含有四元环结构的化合物的结构简式为____________________。
某种豆类作物中所含的天然蛋白质在酶的作用下发生水解,可得到甲、乙两种氨基酸。已知甲的结构简式为: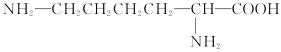 ,乙的分子式为C4H7O4N。
,乙的分子式为C4H7O4N。
(1)由甲形成的三肽中氨基、羧基的数目依次为__________、__________。
(2)若乙不能发生银镜反应,其分子中没有甲基,则乙的结构简式为____________________。
(3)乙的分子中的—NH2和—COOH发生分子内缩合反应脱去一分子水,所形成的含有四元环结构的化合物的结构简式为____________________。