有人设计了如图所示实验装置,目的是做钠与水反应实验并验证:①钠的物理性质;②钠与水反应的产物是什么?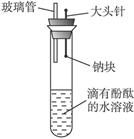
(1)当进行适当操作时还需要的仪器有_____________________________。
(2)如何进行操作?_____________________________________________。
(3)实验现象是_________________________________________________。
有人设计了如图所示实验装置,目的是做钠与水反应实验并验证:①钠的物理性质;②钠与水反应的产物是什么?
(1)当进行适当操作时还需要的仪器有_____________________________。
(2)如何进行操作?_____________________________________________。
(3)实验现象是_________________________________________________。